การอ้างอิง: ปกฉัตร ชูติวิศุทธิ์. (2563). ปรอทและจุลินทรีย์ บทบาทของจุลินทรีย์ในการขับเคลื่อนวัฏจักรทางชีวธรณีเคมีของปรอทในสิ่งแวดล้อม. วารสารสิ่งแวดล้อม, ปีที่ 24 (ฉบับที่ 2).
บทความ: ปรอทและจุลินทรีย์ บทบาทของจุลินทรีย์ในการขับเคลื่อนวัฏจักรทางชีวธรณีเคมีของปรอทในสิ่งแวดล้อม
ปรอท คือธาตุโลหะหนักที่มีความเป็นพิษต่อสิ่งมีชีวิต และเป็นหนึ่งในสารมลพิษที่มีการกระจายตัวปนเปื้อนในสิ่งแวดล้อมจากกิจกรรมในภาคอุตสาหกรรม เช่น การทำเหมืองทอง การเผาถ่านหิน กระบวนการผลิตปูนซีเมนต์ กระบวนการผลิตเหล็กและโลหะ กระบวนการคลออัลคาไลน์เพื่อการผลิตคลอรีนและโซดาไฟ กระบวนการกลั่นน้ำมัน รวมถึงการใช้ปรอทในผลิตภัณฑ์ต่าง ๆ เช่น หลอดฟลูออเรสเซนต์ แบตเตอรี่ และวัสดุที่ใช้ในการอุดฟัน (อ้างอิงข้อมูลจาก https://www.epa.gov/international-cooperation/mercury-emissions-global-context#types) โดยปรอทในรูปใด ๆ ก็ตามสามารถก่อความเป็นพิษต่อสิ่งมีชีวิต โดยเฉพาะปรอทอินทรีย์ที่มักพบในรูปของเมทิลเมอร์คิวรี่ (Methylmercury) ซึ่งเป็นสารที่มีพิษต่อระบบประสาท (อ้างอิงจาก Committee on the Toxicological Effects of Methylmercury, 2000) และนับเป็นปรอทที่มีความเป็นพิษมากที่สุดเมื่อเทียบกับปรอทในรูปอื่น ๆ เนื่องจากมีความสามารถในการละลายในไขมันและสามารถจับกับโปรตีนในเซลล์ จึงถูกขับออกจากร่างกายได้ยากและสามารถสะสมได้เป็นปริมาณมาก ทั้งยังก่อความเป็นพิษได้ที่ความเข้มข้นซึ่งต่ำกว่าปรอทอนินทรีย์มาก (Boening, 2000; Fitzgerald and Clarkson, 1991)
ซึ่งไอออนของปรอทที่มีประจุบวก จะสามารถจับกับไอออนอื่นที่มีประจุลบ เช่น ไฮดรอกไซด์ คลอไรด์ และซัลไฟด์ เกิดเป็นสารประกอบต่าง ๆ เช่น Hg(OH)2, HgCl2, HgSO4 และ HgS ส่วนสารประกอบปรอทอินทรีย์ มักพบในรูปของโมโนเมทิลเมอร์คิวรี่ (CH3Hg+) และไดเมทิลเมอร์คิวรี่ ((CH3)2Hg) ซึ่งสารอินทรีย์ปรอทเหล่านี้นอกจากจะมีความเป็นพิษสูง ยังมีความสามารถในการเคลื่อนที่ในสิ่งแวดล้อมและสามารถสะสมได้ในสิ่งมีชีวิต (Bioaccumulation) โดยการสะสมจะยิ่งเพิ่มปริมาณมากขึ้นในสิ่งมีชีวิตที่อยู่ด้านบนของห่วงโซ่อาหาร ผ่านการถ่ายเทสารมลพิษเป็นทอด ๆ ภายในห่วงโซ่ (Biomagnification) นอกจากนี้ ไอออนของปรอทยังสามารถจับได้กับอนุภาคและสารอินทรีย์ละลายน้ำ (Dissolved organic matter) ซึ่งการจับตัวของปรอทกับสารเหล่านี้ออกมาเป็นปรอทสปีชี่ส์ต่าง ๆ (Mercury speciation) เป็นปัจจัยที่มีผลอย่างมากต่อการหมุนเวียนวัฏจักรของปรอทในธรรมชาติ ทั้งในแง่ของปรอทที่จะถูกจับไว้ภายในระบบนิเวศและในแง่ของการขับเคลื่อนปรอทออกไปยังสิ่งแวดล้อมอื่น ๆ (Skyllberg, 2012)
การปนเปื้อนของเมทิลเมอร์คิวรี่ในสิ่งแวดล้อม เคยสร้างปรากฏการณ์ก่อโรค “มินามาตะ” ในมนุษย์ โดยเหตุการณ์นี้ถูกค้นพบที่เมืองมินามาตะ ประเทศญี่ปุ่น ในปี ค.ศ.1956 หลังจากพบว่ามีผู้คนล้มป่วยเป็นจำนวนมากจากการได้รับเมทิลเมอร์คิวรี่เข้าสู่ร่างกาย ผ่านการบริโภคอาหารทะเลที่ได้จากอ่าวมินามาตะ ซึ่งมีปริมาณปรอทสะสมอยู่ในช่วง 5-35 ส่วนในล้านส่วน โดยเกิดจากการปล่อยน้ำเสียของโรงงานสารเคมีขนาดใหญ่ในพื้นที่ จนทำให้พบปริมาณปรอทสะสมในเส้นผมของผู้คนที่อาศัยในบริเวณนั้นสูงถึง 700 ส่วนในล้านส่วน (Harada, 1995) ซึ่งนับเป็นความเข้มข้นที่สูงมากเมื่อเทียบกับเส้นผมของคนทั่วไปที่จะพบปรอทได้เพียง 2 ส่วนในล้านส่วน (Hong et al., 2012) การสะสมของปรอทในสิ่งมีชีวิตก่อให้เกิดความผิดปกติในการรับความรู้สึก เกิดภาวะกล้ามเนื้อเสียสหการ มีอาการเซ มือสั่น ลิ้นแข็ง พูดไม่ชัด รวมถึงเกิดปัญหาด้านการมองเห็นและการได้ยิน เหตุการณ์นี้นำมาซึ่งการตื่นตัวต่อประเด็นการปนเปื้อนเมทิลเมอร์คิวรี่ในสิ่งแวดล้อม ซึ่งการปนเปื้อนสามารถเกิดขึ้นได้ทั้งจากการทิ้งปรอทในรูปเมทิลเมอร์คิวรี่โดยตรงผ่านกิจกรรมของมนุษย์ หรือจากการที่ปรอทอื่น ๆ ถูกเปลี่ยนรูปเป็นเมทิลเมอร์คิวรี่ผ่านกระบวนการทางชีวธรณีเคมีในวัฏจักรทางธรรมชาติ
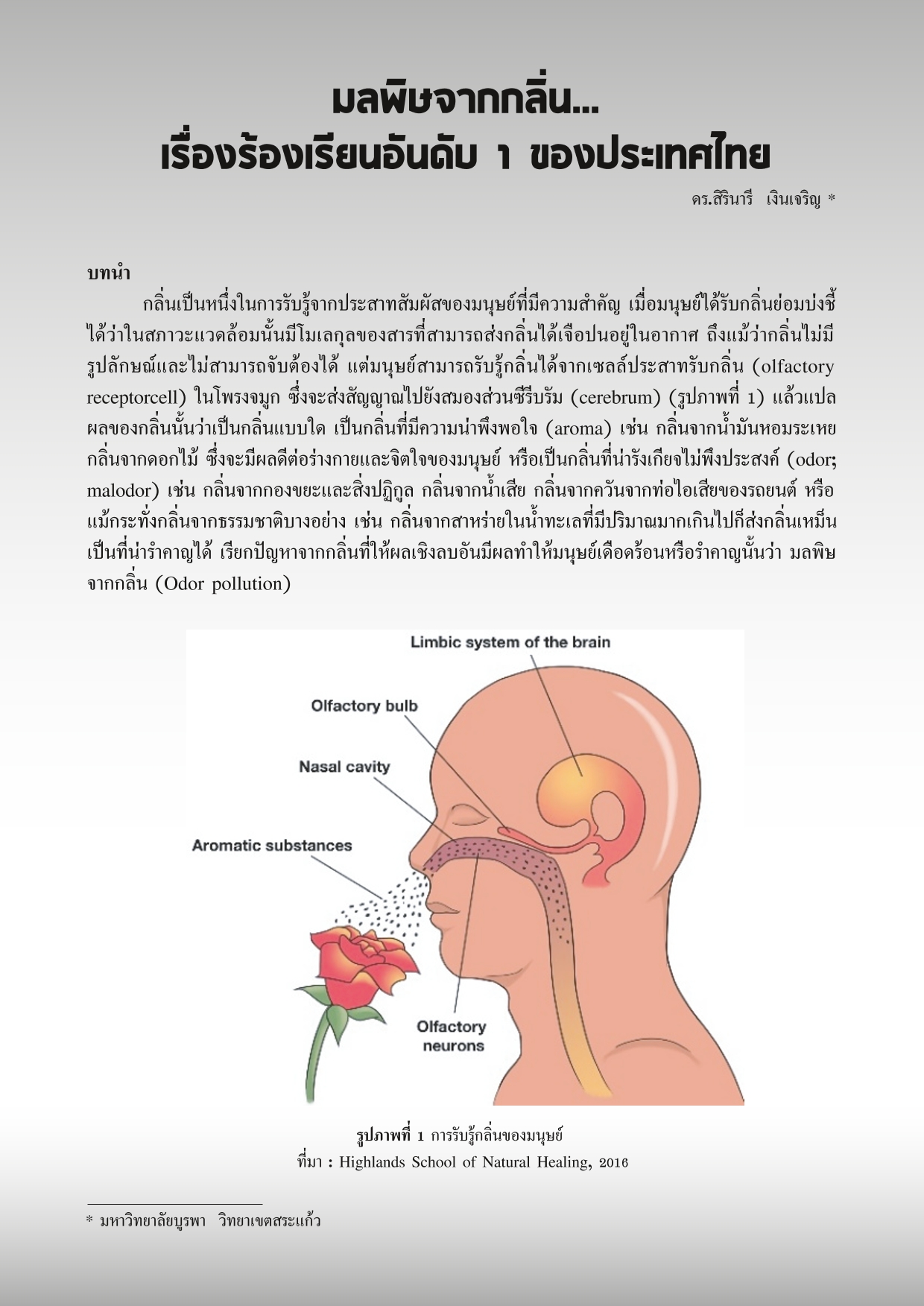
การเปลี่ยนรูปของปรอท เป็นกระบวนการที่เกิดขึ้นหมุนเวียนเป็นวัฎจักร หรือที่เรียกกันว่าวัฏจักรชีวธรณีเคมี (Biogeochemical cycle) ที่เกิดจากปฏิกิริยาทั้งทางชีววิทยา ธรณีวิทยา และทางเคมีที่มีต่อธาตุ ๆ หนึ่ง ส่งผลให้เกิดการเปลี่ยนรูปฟอร์มและเกิดการเคลื่อนที่ของธาตุนั้นในสิ่งแวดล้อม โดยวัฏจักรชีวธรณีเคมีของธาตุหลักต่าง ๆ (เช่น คาร์บอน ไนโตรเจน ซัลเฟอร์) ล้วนมีกิจกรรมทางชีววิทยาซึ่งขับเคลื่อนโดยสิ่งมีชีวิตขนาดเล็กจำพวกจุลินทรีย์เข้ามาเกี่ยวข้อง และนับเป็นสิ่งมีชีวิตหลักที่มีบทบาทในการหมุนเวียนธาตุ ให้เกิดการเปลี่ยนรูปผ่านการเปลี่ยนสถานะรีดอกซ์ (Redox state) และการเปลี่ยนรูประหว่างสารอินทรีย์และสารอนินทรีย์ การเปลี่ยนรูปนี้ทำให้คุณสมบัติทางฟิสิกส์และเคมีของธาตุนั้น ๆ เปลี่ยนแปลงไป ก่อให้เกิดการเคลื่อนที่ของธาตุระหว่างตัวกลางในธรรมชาติ อันได้แก่ ดิน น้ำ อากาศ และสิ่งมีชีวิต แม้แต่โลหะหนักที่มีความเป็นพิษอย่างปรอท ก็มีการขับเคลื่อนวัฏจักรชีวธรณีเคมีผ่านทางจุลินทรีย์เช่นเดียวกัน โดยกระบวนการหลักที่มีจุลินทรีย์เข้ามาเกี่ยวข้องในการเปลี่ยนรูปปรอท แสดงไว้ดังรูปที่ 1
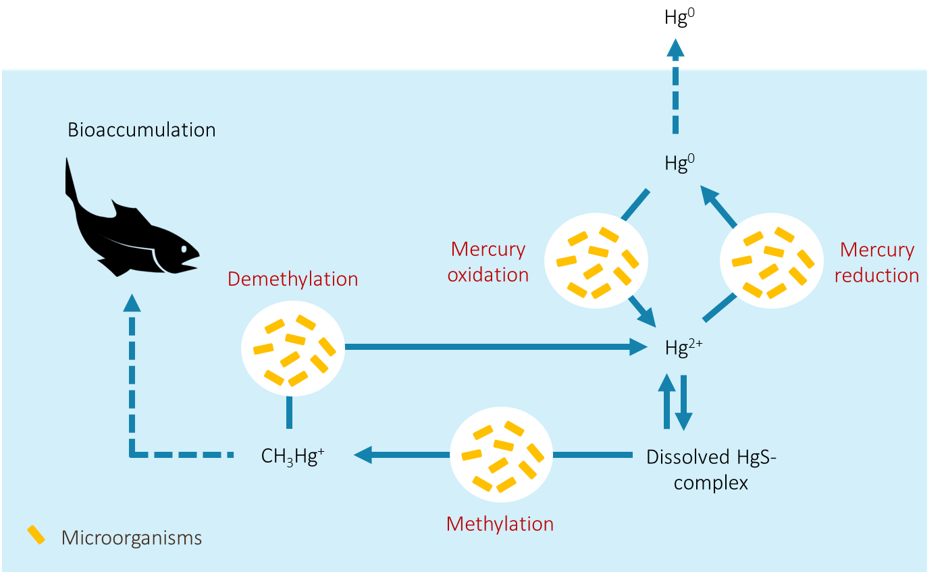
กระบวนการทางชีวธรณีเคมีของปรอทที่ขับเคลื่อนโดยจุลินทรีย์ สามารถออกแบ่งได้เป็น 4 กระบวนการหลัก ได้แก่ 1) กระบวนการเปลี่ยนรูปไอออนของปรอท (Hg2+) เป็นรูปปรอทไม่มีประจุ (Hg0) หรือเมอร์คิวรี่รีดักชัน (Mercury reduction) 2) กระบวนการเปลี่ยนรูป Hg2+ เป็นเมทิลเมอร์คิวรี่ หรือเมทิลเลชัน (Methylation) 3) กระบวนการเปลี่ยนรูปเมทิลเมอร์คิวรี่เป็น Hg2+ หรือดีเมทิลเลชัน (Demethylation) และ 4) กระบวนการเปลี่ยนรูป Hg0 เป็น Hg2+ หรือเมอร์คิวรี่ออกซิเดชัน (Mercury oxidation) โดยกระบวนการเหล่านี้ต่างถูกขับเคลื่อนโดยวิถีเมแทบอลิซึม (Metabolic pathway) เฉพาะ กล่าวคือแต่ละกระบวนการมีเอนไซม์ซึ่งใช้ในการเร่งปฏิกิริยาที่แตกต่างกัน
ในพื้นที่ที่มีการสะสมตัวของปรอท มักพบจุลินทรีย์ที่สามารถเร่งปฏิกิริยาเมอร์คิวรี่รีดักชัน ผ่านกลไกการป้องกันตัวเองจากพิษปรอทของจุลินทรีย์ ซึ่งขับเคลื่อนโดยกลุ่มยีน mer ที่ประกอบไปด้วยยีนหลักคือ merA ที่มีหน้าที่ในการสร้างเอนไซม์ Mercuric reductase ซึ่งจะเปลี่ยน Hg2+ ที่มีความไวต่อการเกิดปฏิกิริยาและมีความสามารถในการละลายน้ำสูง ไปเป็น Hg0 อะตอมเดี่ยวที่มีความเสถียรต่อการเกิดปฏิกิริยามากกว่า ทั้งมีความสามารถในการละลายน้ำต่ำและมีความดันไอสูง จึงเกิดการแพร่ออกจากเซลล์ได้ง่าย (Barkay et al., 2003) ปรอทในรูปนี้จึงมักหลุดจากแหล่งน้ำหรือตะกอนขึ้นไปสู่อากาศ และเป็นรูปของปรอทหลักที่พบเจอได้ในชั้นบรรยากาศ โดยพบว่าปฏิกิริยาทางชีวภาพที่เปลี่ยน Hg2+ ไปเป็น Hg0 นี้เป็นกระบวนการสำคัญที่ทำให้เกิดการเคลื่อนที่ของปรอทระหว่างตัวกลางต่าง ๆ (Skyllberg, 2012)
นอกจากยีน merA แล้ว ในจุลินทรีย์ที่สามารถปกป้องตัวเองจากปรอทได้เหล่านี้ยังมียีนอื่น ๆ ในกลุ่มยีนmer ได้แก่ ยีน merT, merC, merP, merH, merF และ merE ซึ่งเป็นยีนที่มีหน้าที่สร้างโปรตีนสำหรับนำปรอทเข้าสู่เซลล์ของจุลินทรีย์ และมียีน merR เป็นยีนที่คอยควบคุมการทำงานของยีนต่าง ๆ ในกลุ่ม mer รวมถึงยีน merB ซึ่งมีบทบาทสำคัญในการสร้างเอนไซม์ที่สามารถเปลี่ยนปรอทในรูปเมทิลเมอร์คิวรี่ให้กลับมาอยู่ในรูป Hg2+ ที่สามารถจะถูกเปลี่ยนรูปต่อให้เป็น Hg0 ได้โดยยีน merA (Barkay et al., 2003; Barkay et al., 2010; Dash and Das, 2012; Skyllberg, 2012)
ในส่วนของแบคทีเรีย พบ merA ในไฟลัม Proteobacteria ทั้งในคลาส Alpha, Beta และ Gamma รวมถึงในไฟลัม Firmicutes และ Actinobacteria ซึ่งล้วนเป็นไฟลัมหลักของแบคทีเรีย รวมทั้งพบยีน merA ในไฟลัม Deinococcus/Thermus, Aquificae, Bacteriodetes, Chloroflexi, Nitrospirae และ Verrucomicrobia โดย Barkay et al. (2010) ได้ให้คำอธิบายไว้ว่ายีน merA นั้นจำกัดวงอยู่ในจุลินทรีย์ที่สามารถดำรงชีวิตภายใต้สภาวะแวดล้อมที่ปรอทจะอยู่ในรูป Hg2+ ซึ่งเป็นรูปของปรอทที่มีความไวต่อการเกิดปฏิกิริยา ส่งผลให้จุลินทรีย์ที่มีวิวัฒนาการในการต้านทานปรอท เป็นกลุ่มที่อาศัยอยู่ภายใต้สภาวะทางรีดอกซ์และค่าพีเอชที่ขับเคลื่อนให้ปรอทอยู่ในรูป Hg2+ เป็นหลัก ในขณะที่สภาวะแวดล้อมซึ่งขับเคลื่อนให้ปรอทอยู่ในรูปที่เสถียรกว่า เช่น Hg0 หรือเมอร์คิวรี่ซัลไฟด์ (HgS) มักไม่พบจุลินทรีย์ที่มียีน merA จึงกล่าวได้ว่ารูปฟอร์มของปรอทเป็นปัจจัยหลักในการคัดเลือกจุลินทรีย์ที่มีความสามารถในการดำรงอยู่ภายใต้สภาวะนั้น ๆ
นอกจากยีนกลุ่ม mer แล้ว ยีนที่นักวิจัยซึ่งศึกษากระบวนการชีวธรณีเคมีของปรอทให้ความสนใจกันมาก คือกลุ่มยีนที่สามารถเปลี่ยนรูปของปรอทให้เป็นเมทิลเมอร์คิวรี่ได้ ซึ่งก็คือยีน hgcA และ hgcB โดยยีนทั้งสองตัวนี้ทำหน้าที่ร่วมกันในการสร้างเมทิลเมอร์คิวรี่จาก Hg2+ ภายในเซลล์ของจุลินทรีย์ โดยพบว่าจุลินทรีย์กลุ่มหลักในสิ่งแวดล้อมที่มีบทบาทในการสร้างเมทิลเมอร์คิวรี่อยู่ในกลุ่มแบคทีเรียที่ใช้ซัลเฟตในการหายใจ หรือที่เรียกว่าปฏิกิริยารีดักชัน (Sulfate-reducing bacteria) (Barkay et al., 2003; Skyllberg, 2012)
ทั้งจุลินทรีย์ที่ใช้ซัลเฟต ไอออนของเหล็ก และกลุ่มสร้างมีเทน ล้วนเป็นจุลินทรีย์ที่เติบโตภายใต้สภาวะไร้อากาศ โดยในงานวิจัยที่ผ่านมาพบว่า รูปฟอร์มของปรอทในสภาวะไร้อากาศจะถูกควบคุมโดยปฏิกิริยาระหว่างไอออนของปรอทกับซัลไฟด์และสารอินทรีย์ธรรมชาติ (Natural organic matter) เป็นหลัก ซึ่งปฏิกิริยาเหล่านี้จะเป็นตัวกำหนดปริมาณปรอทที่ใช้ได้ในทางชีวภาพ (Bioavailability) โดยปรอทในรูป Hg2+ มีความสามารถสูงมากในการจับกับสารประกอบซัลไฟด์และธาตุหมู่ 7 (Halides) (Skyllberg, 2012) ส่วนในสารอินทรีย์ธรรมชาติ ปรอทจะสามารถจับกับหมู่ซัลฟ์ไฮดริล (Sulfhydryl functional groups) ซึ่งมีซัลเฟอร์เป็นองค์ประกอบ (Hsu-Kim et al., 2013)
อย่างไรก็ตาม รูปฟอร์มของปรอทที่จุลินทรีย์สามารถใช้ได้ภายใต้สภาวะไร้อากาศนั้น ยังไม่เป็นที่เข้าใจกันมากนัก มีการตั้งทฤษฎีว่าจุลินทรีย์สร้างเมทิลเมอร์คิวรี่สามารถนำปรอทเข้าสู่เซลล์ได้โดยการลำเลียงแบบไม่ใช้พลังงาน (Passive transport) ทำให้รูปฟอร์มหลักของปรอทที่สามารถเข้าสู่เซลล์ได้ด้วยวิธีนี้ คือสารประกอบปรอทขนาดเล็กที่ไม่มีประจุ เช่น Hg(HS)20 และ HgS0 ที่ละลายน้ำ (Hsu-Kim et al., 2013) รวมถึงทฤษฎีที่กล่าวว่าจุลินทรีย์สร้างเมทิลเมอร์คิวรี่ สามารถนำปรอทเข้าสู่เซลล์ด้วยการลำเลียงแบบใช้พลังงาน (Active transport) ซึ่งปรอทที่สามารถนำเข้าสู่เซลล์ได้ด้วยวิธีนี้ ได้แก่ปรอทที่จับกับหมู่ไทออล (Thiol group) ซึ่งเป็นสารประกอบอินทรีย์ซัลเฟอร์ที่ถูกสร้างได้โดยจุลินทรีย์ และสามารถสะสมเป็นปริมาณมากภายใต้สภาวะที่มีออกซิเจนต่ำหรือไร้ออกซิเจน (Adediran et al., 2019; Skyllberg, 2012)
จากการวิเคราะห์ฐานข้อมูลจีโนมและลำดับนิวคลีโอไทด์โดย McDaniel et al. (2019) พบว่าจุลินทรีย์สร้างเมทิลเมอร์คิวรี่ที่มีอยู่ในฐานข้อมูลปัจจุบัน ครึ่งหนึ่งจัดอยู่ในไฟลัม Deltaproteobacteria, Firmicutes, Euryarchaeota และ Bacteroidetes และโดยส่วนใหญ่เป็นแบคทีเรียที่ใช้ซัลเฟตในการหายใจ (ในคลาส Delta-proteobacteria) นอกจากนี้ยังมีจุลินทรีย์กลุ่มอื่น ๆ ซึ่งมีการค้นพบไม่นานมานี้ว่ามีบทบาทต่อการสร้างเมทิลเมอร์คิวรี่ในสิ่งแวดล้อมเช่นกัน ได้แก่ แบคทีเรียในไฟลัม Spirochaetes, Planctomycetes, Verrucomicrobia, Chlamydiae และ Lentisphaerae รวมถึงการค้นพบยีน hgcA ในแบคทีเรียกลุ่ม Nitrospirae, Chloroflexi, Elusimicrobia และ Actinobacteria ซึ่งไม่เคยมีการรายงานมาก่อนว่ามีจุลินทรีย์สร้างเมทิลเมอร์คิวรี่อยู่ภายในไฟลัม ดังนั้นจะเห็นได้ว่าการสร้างเมทิลเมอร์คิวรี่เป็นคุณสมบัติที่พบได้ในจุลินทรีย์หลากหลายชนิด นอกเหนือไปจากกลุ่มที่เป็นที่รู้จักกันดีอย่างแบคทีเรียที่ใช้ซัลเฟตในการหายใจ
ปริมาณของเมทิลเมอร์คิวรี่ที่ตกค้างในสิ่งแวดล้อม เป็นผลระหว่างการทำงานของจุลินทรีย์สร้างเมทิลเมอร์คิวรี่กับจุลินทรีย์ที่สามารถทำให้เกิดดีเมทิลเลชัน หรือปฏิกิริยาที่เปลี่ยนเมทิลเมอร์คิวรี่กลับเป็น Hg2+ ซึ่งเกิดจากการทำงานของเอนไซม์ Organomercury lyase ที่สร้างขึ้นโดยยีน merB โดยยีนนี้จะพบได้ในแบคทีเรียไฟลัม Actinobacteria, Firmicutes และ Proteobacteria (Barkay et al., 2010) การทำงานของยีน merB จะช่วยลดการสะสมของเมทิลเมอร์คิวรี่ที่ถูกสร้างขึ้นในระบบนิเวศ อย่างไรก็ตาม ข้อมูลของยีน merB ในฐานข้อมูลจีโนมและลำดับนิวคลีโอไทด์ยังมีไม่มากนักเมื่อเทียบกับยีนอื่น ๆ ส่งผลให้องค์ความรู้เกี่ยวกับจุลินทรีย์ที่สามารถทำให้เกิดปฏิกิริยาดีเมทิลเลชันได้ยังมีอยู่จำกัดในปัจจุบัน
นอกจากกระบวนการต่าง ๆ ที่กล่าวมาข้างต้น ยังมีปฏิกิริยาเปลี่ยนรูปปรอทที่ขับเคลื่อนโดยจุลินทรีย์อีกกระบวนการหนึ่ง ซึ่งสามารถเปลี่ยนรูปปรอท Hg0 กลับเป็น Hg2+ ได้ หรือที่เรียกว่าปฏิกิริยาเมอร์คิวรี่ออกซิเดชัน โดยเป็นปฏิกิริยาที่มีการศึกษาน้อยที่สุดเมื่อเทียบกับกระบวนการเปลี่ยนรูปปรอทอื่น ๆ แต่นับเป็นปฏิกิริยาที่มีความสำคัญในแง่ของการเพิ่มปริมาณ Hg2+ และลดปริมาณ Hg0 ในระบบนิเวศ ซึ่ง Hg2+ จากปฏิกิริยานี้จะสามารถเวียนกลับเข้าสู่กระบวนการเมอร์คิวรี่รีดักชันหรือกระบวนการเมทิลเลชันได้ ทั้งนี้ขึ้นอยู่กับสภาวะแวดล้อมที่ Hg2+ อยู่ในขณะนั้น โดยเมอร์คิวรี่ออกซิเดชันเกิดจากการทำงานของเอนไซม์ Hydroperoxidases ที่สร้างขึ้นโดยยีน katG และ katE ซึ่งจากการศึกษาของ Smith et al. (1998) พบว่าแบคทีเรียที่พบได้ในดินที่อากาศเข้าถึงอย่าง Streptomyces และ Bacillus มีปฏิกิริยาการเปลี่ยน Hg0 เป็น Hg2+ ในอัตราที่สูง แสดงให้เห็นถึงความสามารถในการเกิดเมอร์คิวรี่ออกซิเดชันในดิน อย่างไรก็ตาม พบว่าในจุลินทรีย์ที่มีกลไกต้านทานปรอท จะเกิดอัตราเมอร์คิวรี่ออกซิเดชันต่ำกว่าเมอร์คิวรี่รีดักชันอย่างน้อย 10 เท่า (Barkay et al., 2003) เมื่ออ้างอิงจากข้อมูลที่มีอยู่ในปัจจุบันจะเห็นได้ว่า โอกาสในการเปลี่ยน Hg0 เป็น Hg2+ จะเกิดขึ้นได้น้อยกว่าปฏิกิริยาจาก Hg2+ เป็น Hg0
นอกจากปฏิกิริยาทางชีวภาพแล้ว การเปลี่ยนรูปของปรอทยังสามารถเกิดขึ้นได้ผ่านปฏิกิริยารีดักชันแบบใช้แสง (Photoreduction) โดยพบว่าภายใต้สภาวะแวดล้อมที่มีแสงสว่างส่องถึง แสงจะเป็นปัจจัยหลักที่ขับเคลื่อนการเปลี่ยนรูปของปรอท ซึ่งสามารถจะถูกเปลี่ยนรูปจาก Hg2+ เป็น Hg0 ได้เช่นเดียวกับปฏิกิริยาของจุลินทรีย์ รวมถึงการเปลี่ยนรูป Hg0 เป็น Hg2+ ก็สามารถเกิดผ่านปฏิกิริยาออกซิเดชันแบบใช้แสง (Photooxidation) ได้เช่นกัน (Vost et al., 2012) แสงจึงเป็นอีกหนึ่งปัจจัยสำคัญที่ส่งผลต่อรูปฟอร์มและการเคลื่อนที่ของปรอทในสิ่งแวดล้อมนั้น ๆ นอกเหนือไปจากปฏิกิริยาที่เกิดขึ้นทางเคมีและทางชีวภาพ